原文公众号:一起实验网 对下述分析方法感兴趣或者没有研究思路的小伙伴,欢迎踊跃探讨!
早!今天小编和大家分析一篇22年10月发表在Journal of Translational Medicine(IF:5.5)杂志的文章《Transcriptome-based network analysis related to M2-like tumor-associated macrophage infiltration identified VARS1 as a potential target for improving melanoma immunotherapy efficacy》。作者建立了M2样TAM相关预后模型,用于预测黑色素瘤的预后和免疫治疗耐药性,并探讨了VARS1在黑色素瘤免疫治疗中的潜在预测价值。这项研究的思路拓宽了目前对于M2样TAM在黑色素瘤生物学和预后预测中的作用的理解。该思路同样适用于其他肿瘤的研究,有相关需求的老师欢迎联系我们。
背景&方法
 背景
背景
骨髓细胞穿透肿瘤并分化成巨噬细胞,称为肿瘤相关巨噬细胞(TAMs),它是肿瘤浸润白细胞的主要组成部分。大多数TAMs不仅失去了对抗肿瘤进展的能力,而且还支持肿瘤细胞生长和转移。TAMs通过分泌多种免疫抑制细胞因子,帮助肿瘤建立免疫功能失调的微环境。此外,作为PD-L1的主要来源,TAMs抑制细胞毒性T细胞的浸润和功能,这导致了对新辅助免疫治疗的不良耐药性。在肿瘤中,TAMs主要极化成促肿瘤的M2表型,而M2/M1比值高是许多癌症的独立预后因素,尤其是黑色素瘤。因此,有必要结合黑色素瘤患者的M2样TAM浸润描述分子特征,确定M2样TAM极化的关键调节因素。
方法
1.GEO和TCGA公共数据库获取黑色素瘤(SKCM)数据;
2.WGCNA和一致性构建共表达网络获取M2样TAM相关簇;
3.GSVA分析激活的信号通路;
4.体细胞突变和体细胞拷贝数改变分析评估基因组的改变;
5.单因素和LASSO构建M2巨噬细胞簇相关预后模型;
6.CIBERSORT分析高低风险人群免疫细胞浸润差异;
7.PPI和DepMap数据库鉴定关键基因;
8.侵袭和转移实验探索关键基因在SKCM巨噬细胞极化中的作用;
9.流式细胞术分析关键基因与M2巨噬细胞计划的相关性;
10.SubMap分析探索关键基因预测ICB临床获益的可能性。
研究结果 1.M2样TAM相关簇的识别
作者首先使用CIBERSORT算法评估患者免疫细胞浸润的比例,并发现M2巨噬细胞浸润比例较高的患者预后较差。考虑到M2巨噬细胞与较差的预后有关,作者进行WGCNA分析发现黄色模块与M2巨噬细胞浸润最相关。基于黄色模块预后相关基因的一致性聚类确定了两个簇,且两个簇的总生存期(OS)存在显著差异。
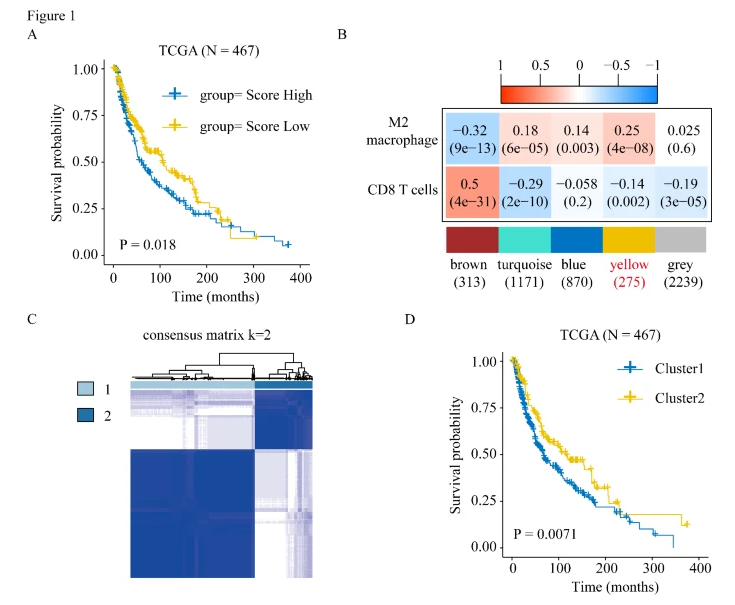 2.功能富集分析
2.功能富集分析
GSEA分析用来证明每个簇中激活的信号通路,M2巨噬细胞途径在簇1中显著激活。TCGA-SKCM肿瘤分为3种亚型:(1)免疫型,(2)角蛋白和(3)MITF低型。与簇2相比,簇1包含更高比例的角蛋白亚型(57%对13%)和更低的免疫亚型比例(34.7%对56.2%)。与簇1相比,簇2表现出更高的免疫检查点相关基因表达。
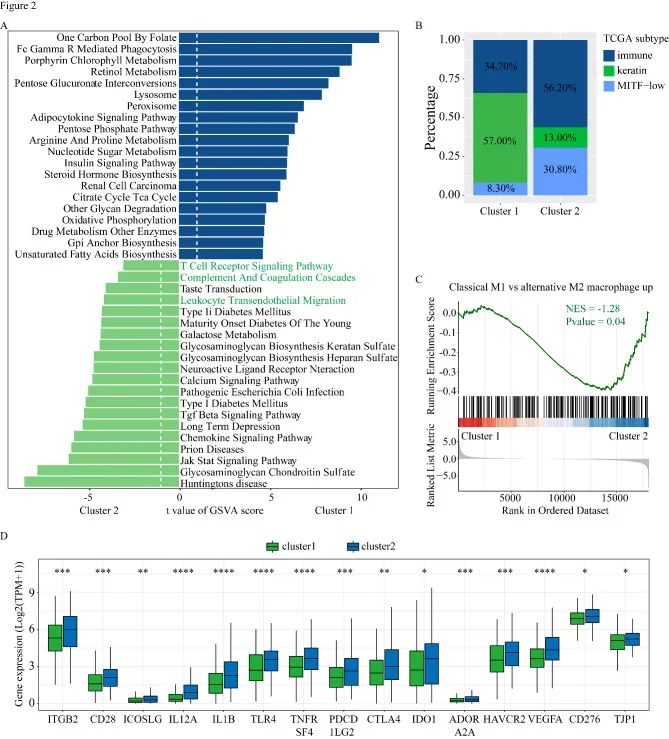 3.突变和拷贝数变异分析
3.突变和拷贝数变异分析
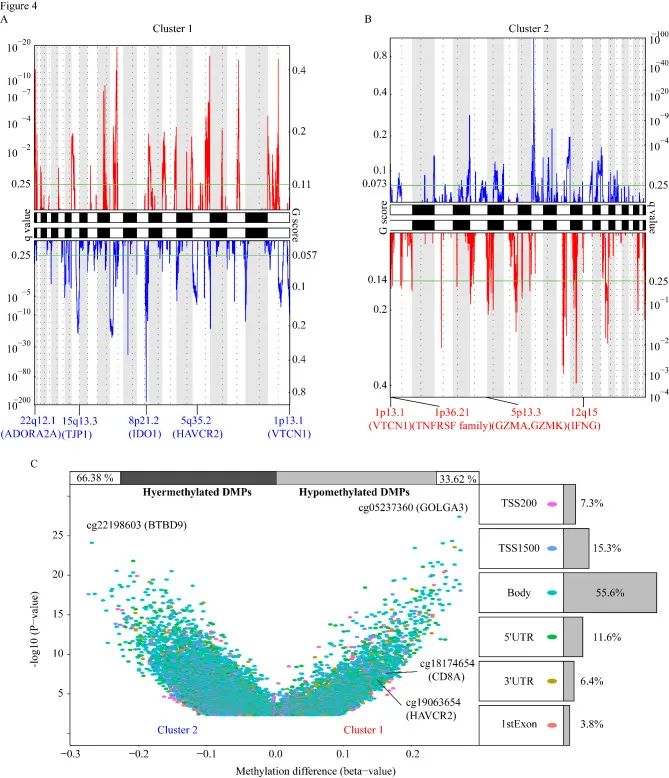
多组学分析用来评估两个簇间突变情况的差异。瀑布图突出显示了两个簇中前20个显着突变基因(SMG)。虽然这两个簇共享了大部分SMG,但XIRP2(31%),FAT4(31%),USH2A(30%)和ANK3(29%)是簇1特有的SMG,而簇2特有的SMG,包括FLG(40%),APOB(40%)和CSMD2(37%)。
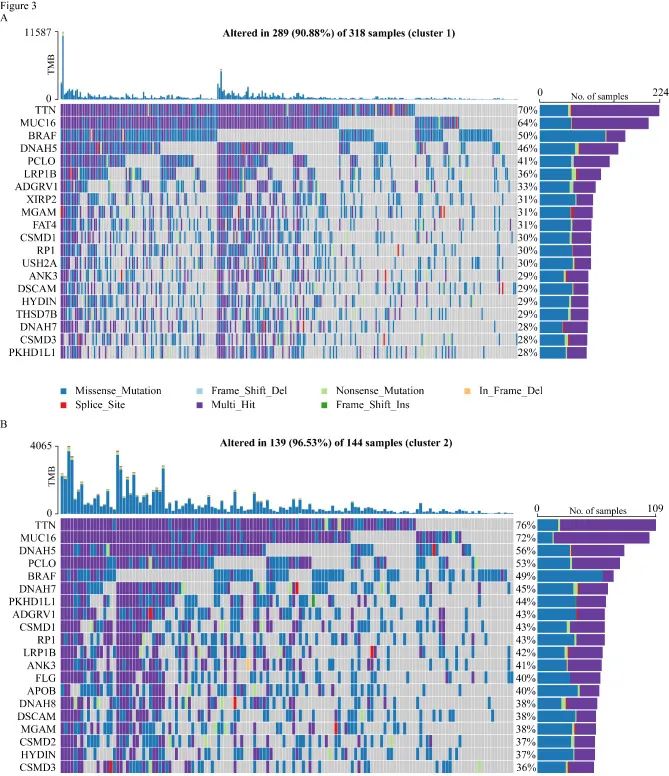 GISTIC 分析体细胞拷贝数变异(SCNV),簇1包含了56个焦点缺失峰和69个焦点扩增峰,而簇2包含了37个焦点缺失峰和28个焦点扩增峰。进一步的甲基化差异分析在簇1和簇2之间获得了28870个差异甲基化探针(DMP)。有趣的是,簇1的CD8A和HAVCR2的甲基化水平高于簇2。
GISTIC 分析体细胞拷贝数变异(SCNV),簇1包含了56个焦点缺失峰和69个焦点扩增峰,而簇2包含了37个焦点缺失峰和28个焦点扩增峰。进一步的甲基化差异分析在簇1和簇2之间获得了28870个差异甲基化探针(DMP)。有趣的是,簇1的CD8A和HAVCR2的甲基化水平高于簇2。
 4.M2巨噬细胞簇相关预后模型的构建
4.M2巨噬细胞簇相关预后模型的构建
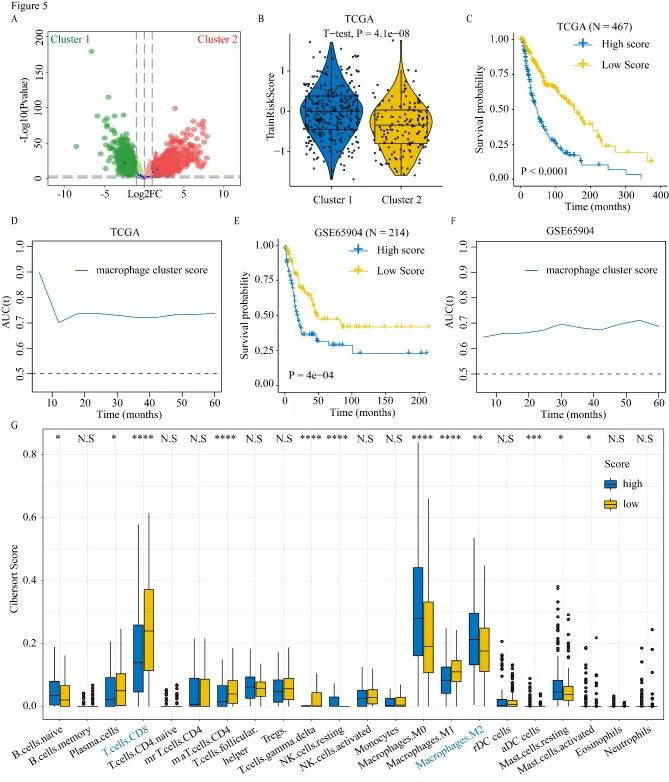
簇1和簇2之间的差异基因用来构建预后模型。1(0.70)、2(0.74)、3(0.72)和5(0.74)年时间依赖性AUC曲线表明,M2巨噬细胞集群相关风险评分对于预测TCGA数据集中黑色素瘤患者的OS具有潜在价值。
 5.高低风险人群免疫细胞浸润和免疫检查点分析
5.高低风险人群免疫细胞浸润和免疫检查点分析
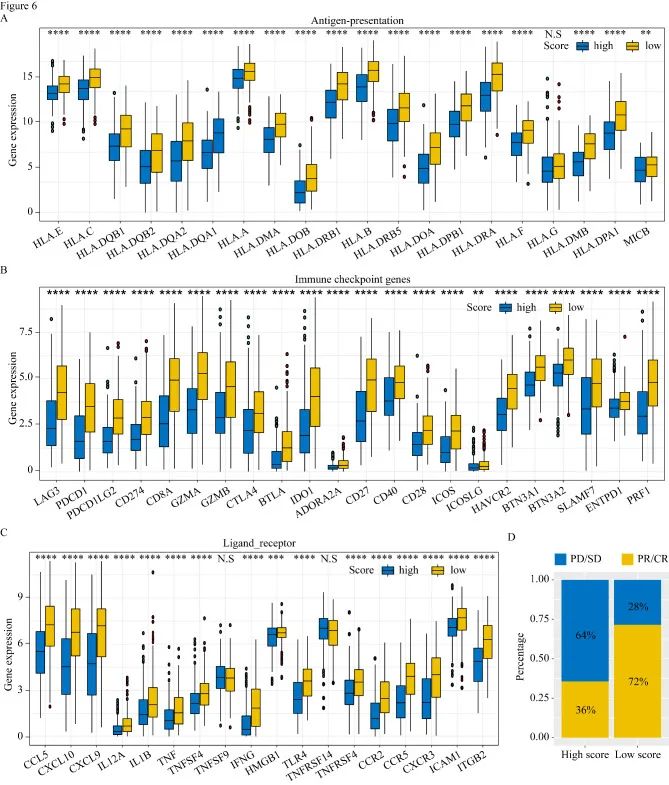
为了评估M2巨噬细胞集群相关风险评分对肿瘤微环境(TME)的影响,作者比较了高分组和低分组之间的免疫细胞浸润。与低风险评分的患者相比,高危评分患者M2巨噬细胞浸润增加,CD8 T细胞浸润减少。高风险评分组抗原呈递和免疫检查点相关基因的表达同样显著增加。为了进一步观察高风险评分组和低风险评分组对免疫治疗的不同反应,作者将M2巨噬细胞簇相关模型应用于具有可用免疫治疗结果的数据集(GSE78220和GSE91061),与低风险评分患者相比,高风险评分患者对免疫治疗无反应的比例更高(64%对28%)。
 6.VARS1在黑色素瘤进展和巨噬细胞极化中的作用鉴定
6.VARS1在黑色素瘤进展和巨噬细胞极化中的作用鉴定
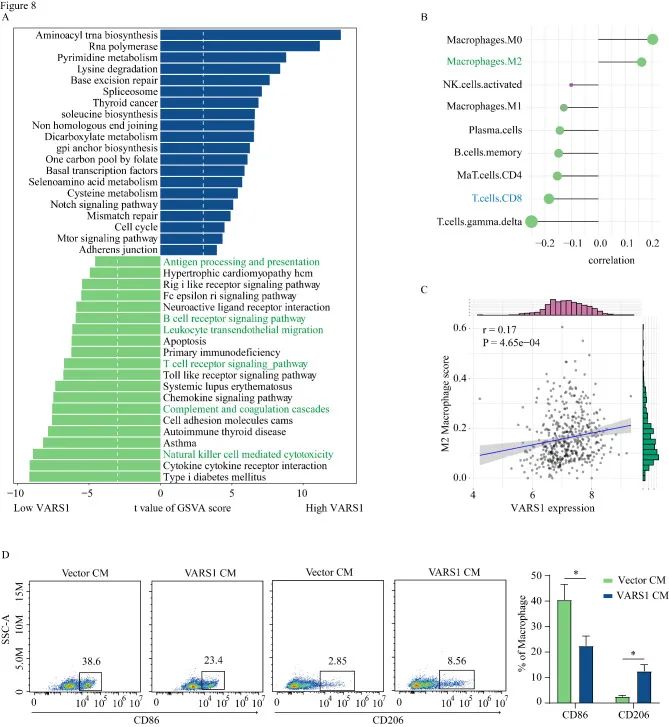
作者根据STRING数据库和DepMap数据库获得了黄色模块基因中的枢纽基因(VARS1),同时发现高VARS1表达与较短的OS相关。为了评估VARS1在黑色素瘤进展中的作用,作者构建了VARS1过表达和VARS1敲除的A375和SK-MEL-28细胞系。VARS1过表达促进了细胞的迁移和侵袭能力,而VARS1抑制显着降低了细胞的迁移和侵袭能力。同时GSEA表明,在TCGA-SKCM数据集中,高VARS1水平与转移相关途径呈正相关。
 7.VARS1与免疫浸润和诱导M2巨噬细胞极化呈负相关
7.VARS1与免疫浸润和诱导M2巨噬细胞极化呈负相关
KEGG通路结果显示,免疫相关通路(如T细胞受体通路)在低VARS1表达患者中富集,而细胞周期通路和mTOR通路等肿瘤生长通路在高VARS1表达患者中富集。为了阐明VARS1在M2巨噬细胞极化中的作用,作者用过表达VARS1和A375载体细胞系的上清液处理THP1细胞,并检测M1和M2巨噬细胞标志物。流式细胞术显示,与用载体-A375-上清液处理的THP1细胞相比,用VARS1-A375上清液处理的THP1细胞中M2巨噬细胞标志物CD206的表达增加了3倍,而M1巨噬细胞标志物CD86的表达降低了15.2%。综上所述,这些结果表明VARS1可能在M2巨噬细胞浸润和极化中起重要作用。
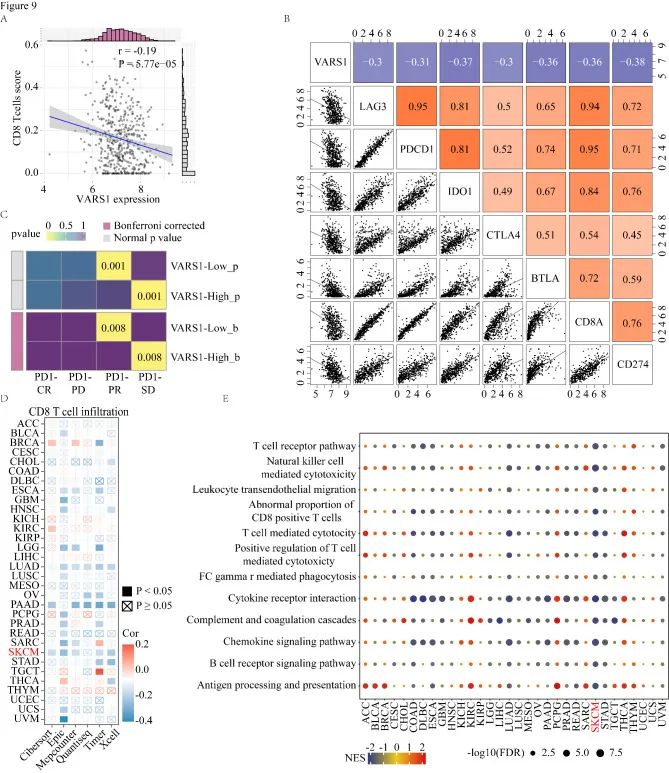
 8.高表达的VARS1与低CD8 T细胞浸润相关,预测ICB的临床效益较差
8.高表达的VARS1与低CD8 T细胞浸润相关,预测ICB的临床效益较差
SubMap分析评估了高和低VARS1表达黑色素瘤患者的抗PD-1免疫治疗反应,结果表明结果表明,VARS1低表达预示着对抗PD -1免疫治疗的部分应答(PR),而VARS1高表达预示着对抗PD-1免疫治疗的耐药(SD)。为了探索VARS1在免疫调节中的抑制作用,作者使用多种的算法来研究Pan-TCGA数据集中VARS1基因表达与CD8 T细胞浸润之间的相关性。结果表明,VARS1基因表达和CD8 T细胞浸润在大多数癌症中呈负相关。